我們已經(jīng)發(fā)現(xiàn)sirtuin重排配體(SirReals)是NAD+依賴型賴氨酸去乙酰化酶Sirt2潛在的選擇性抑制劑。通過生物素化的SirReal和BLI技術(shù),我們已經(jīng)觀測到酶-抑制劑復(fù)合物存在較慢的解離率,這被推測是SirReals具備高親和性和選擇性的關(guān)鍵。然而由于將生物素連接到SirReal的核心區(qū)域,我們將引入一個(gè)三唑啉基團(tuán)做為連接的部分,經(jīng)X射線顯示,該部分與共因子結(jié)合環(huán)中的第97位氨基酸相互作用。因此,我們希望可以闡明,觀測到的SirReals的較長的配體結(jié)合時(shí)間,是由引入的三唑啉基團(tuán)誘導(dǎo),還是SirReal抑制劑內(nèi)部的特性。因此,我們通過一種稱為switchSENCE的無標(biāo)記的全新技術(shù)(該技術(shù)依賴于電驅(qū)動的可擺動的DNA納米桿),證明SirReals較長的結(jié)合時(shí)間是由于其核心骨架本身特性引起的。
蛋白會經(jīng)歷各種翻譯后修飾(PTMs). 這些修飾能夠使得蛋白的活性,定位,相互作用和穩(wěn)定性得到非常精細(xì)的調(diào)節(jié)。與蛋白的磷酸化具有相似的復(fù)雜性和重要性,賴氨酸殘基的ε-amine的乙酰化,成為最普遍存在的蛋白翻譯后修飾的一種。賴氨酸乙酰化是由賴氨酸乙酰基轉(zhuǎn)移酶(KATs)誘導(dǎo),由去乙酰化轉(zhuǎn)移酶(KDACs)去除乙酰化。除了乙酰基之外,還可以添加和移除更長的酰基鏈,包括丙酰基、丁酰基和肉豆蔻酰基,或者由二羧酸(如丙二酸、琥珀酸或谷氨酸酸)衍生出的酰基團(tuán),上述的賴氨酸修飾酶能夠完成這一過程。
人類的基因組中已鑒定出18種不同的KDACs,根據(jù)它們的序列同源性分成四組。Sirtuins, 屬于第三類KDACs,是KDAC家族中比較特殊的成員。雖然一類,二類和四類去乙酰化酶是Zn2+依賴的金屬蛋白酶型的去乙酰化酶,但是7種人的sirtuins亞型為NAD+依賴的催化機(jī)制。在催化反應(yīng)過程中,sirtuins會經(jīng)歷一種構(gòu)象變化過程,從無酶活的“開放構(gòu)象”轉(zhuǎn)變?yōu)椋伲┑孜锝Y(jié)合態(tài)的“封閉構(gòu)象”。Sirt2亞型主要位于細(xì)胞質(zhì),能夠?qū)⒍喾N底物去乙酰化,例如α-tubulin, BubR1, p53, eIF5A和NFκB。Sirt2依賴的去乙酰化對細(xì)胞周期調(diào)節(jié),自噬,周緣髓鞘化和免疫及炎癥應(yīng)答存在主要的影響。除了去乙酰化,Sirt2也催化長鏈脂肪酸的去除。然而,越來越多的研究報(bào)道發(fā)現(xiàn),Sirt2的總體細(xì)胞作用機(jī)制不僅僅依賴于催化活性,也依賴于蛋白和蛋白之間的相互作用,比如KDA6或TTTP/p25。
Sirt2的功能失調(diào)和多種疾病的發(fā)生相關(guān),包括細(xì)菌感染,類型II糖尿病,神經(jīng)退行性疾病和腫瘤,提示Sirt2有希望成為一個(gè)藥物干預(yù)的靶點(diǎn)。然而,對于一些疾病,包括亨廷頓氏病以及一些類型的腫瘤,還未最終被明確Sirt2是被上調(diào),還是被下調(diào)或者被抑制,進(jìn)而改善特定的疾病狀態(tài)。由于迫切需要合適的工具化合物來進(jìn)一步研究 Sirt2 去乙酰化對細(xì)胞的影響,并驗(yàn)證 Sirt2 作為藥物靶點(diǎn)的潛力,因此人們發(fā)現(xiàn)了多種具有藥物特性的 Sirt2 選擇性小分子抑制劑。最近,我們已經(jīng)發(fā)現(xiàn)了一類新的Sirt2高度選擇性抑制劑(請見Figure 1A).這些化合物在較低的uM到nM濃度范圍內(nèi)抑制Sirt2, 然而對于它的相近的同源物Sirt1和Sirt3卻沒有檢測到抑制效應(yīng)(IC50>100uM)。
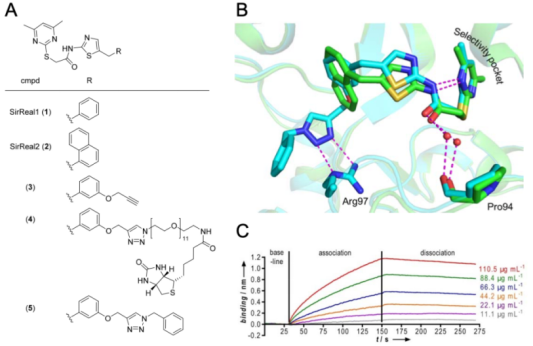
Sirt2與1或2結(jié)合形成的復(fù)合物結(jié)構(gòu)(請見Figure 1A)是 Sirt2與特異性Sirt2 抑制劑結(jié)合的首個(gè)晶體結(jié)構(gòu)。這些數(shù)據(jù)表明抑制發(fā)生的特定模式,一旦配體結(jié)合,Sirt2的激活位點(diǎn)會出現(xiàn)重大改變(請見Figure 1B)。由于激活位點(diǎn)的結(jié)構(gòu)重排,鉸鏈區(qū)的兩個(gè)環(huán)會形成一個(gè)新的結(jié)合口袋,該結(jié)合口袋將羅森曼折疊域與鋅離子結(jié)合域連接了起來。這種現(xiàn)象僅在Sirt2中被觀察到,并且其原因歸結(jié)于Sirt2在活性位點(diǎn)這一特定區(qū)域所具有的獨(dú)特靈活性。因此這種類型的抑制劑被稱為Sirtuin重排配體(SirReals),形成的誘導(dǎo)-契合結(jié)合口袋被稱為選擇性位點(diǎn)。因?yàn)榻?jīng)鑒定,它是Sirt2選擇性的關(guān)鍵。在我們發(fā)現(xiàn)Sirt2的選擇性口袋存在的不久后,研究結(jié)果表明,這個(gè)小囊腔能夠容納一種名為“肉豆蔻酰基”底物的長鏈脂肪酸。同時(shí),其他 Sirt2 抑制劑通過與選擇性凹槽結(jié)合的方式實(shí)現(xiàn)了其亞型選擇性。
因此,我們的目的是研究SirReal-Sirt2相互作用的結(jié)合動力學(xué)。最初嘗試?yán)肐TC檢測結(jié)合和解離動力學(xué),但未能成功,這可能與以下事實(shí)有關(guān):結(jié)合焓值被與重排過程相關(guān)的能量貢獻(xiàn)所掩蓋了。因此,我們將一個(gè)經(jīng)丙炔基化處理的 SirReal 類似物與一個(gè)氨基官能化的生物素進(jìn)行連接,從而得到了一種具有三唑連接的源自 SirReal 的親和探針。該探針在BLI中用于結(jié)合動力學(xué)研究。我們的動力學(xué)結(jié)果顯示一個(gè)非常慢的解離動力學(xué)(請見Figure 1C),表明Sirt2在配體結(jié)合后,Sirt2的活性位點(diǎn)確實(shí)捕獲了SirReal,導(dǎo)致構(gòu)象發(fā)生適應(yīng)性改變。這導(dǎo)致了配體在靶點(diǎn)上的較長的滯留時(shí)間(例如配體-復(fù)合物的半衰期)以及造成的慢的解離(請見Figure 1C).然而,Sirt2與基于三唑的 SirReal 形成的復(fù)合物的共晶體結(jié)構(gòu)表明,三唑部分,在標(biāo)記過程中,做為連接部分被引入,也涉及到通過特定的方式與Sirt2相結(jié)合。三唑部分與共因子結(jié)合環(huán)的第97位精氨酸形成氫鍵(請見Figure 1B).為了闡明,Sirt2的親和探針較長的結(jié)合時(shí)間是由于三唑部分引入引起的,還是僅僅由于SirReal的結(jié)合,我們需要尋找一種新的技術(shù),通過無標(biāo)記技術(shù)檢測該結(jié)合動力學(xué)。
SirReal與Sirt2的結(jié)合動力學(xué)
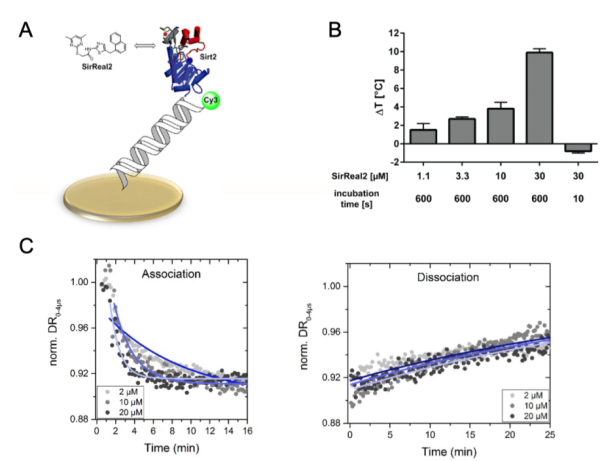
為了通過配體無標(biāo)記法研究Sirt2-SirReal結(jié)合動力學(xué)(Kon, Koff常數(shù)),我們利用了以DNA納米桿為特征的switchSENCE技術(shù)。該方法具有較高的靈敏度,用以檢測未標(biāo)記的小分子和表面偶聯(lián)蛋白的相互作用。在我們的實(shí)驗(yàn)設(shè)計(jì)中,Sirt2經(jīng)共價(jià)偶聯(lián)到短的雙鏈DNA納米桿的一條鏈上,該DNA納米桿與金屬微電極連接。另一條鏈?zhǔn)褂脽晒馊玖蠘?biāo)記,本文使用的是Cy3(請見Figure 2A).通常,該設(shè)計(jì)可通過兩種模式測量。在靜止模式下,配體與DNA納米桿上的蛋白相互作用直接通過DNA納米桿上的熒光信號發(fā)射進(jìn)行表征。然而,值得提到的是,如果結(jié)合不能夠直接影響與DNA連接的熒光探針的熒光特性,就無法利用該模式檢測。在SirReal-Sirt2相互作用下,靜止模式的測量未能產(chǎn)生任何結(jié)合數(shù)據(jù)可以用于進(jìn)一步分析。因此,我們使用了動力學(xué)模式,檢測SirReal-Sirt2的相互作用。switchSENCE技術(shù)在金屬電極表面產(chǎn)生正負(fù)交替變換的電壓,能夠吸引或排斥雙鏈DNA帶有負(fù)電荷的骨架。這使得DNA納米桿產(chǎn)生了一個(gè)方向上的擺動,被稱為“switching”。由于存在一種與距離相關(guān)的無輻射能量傳遞方式,使得染料所發(fā)出的熒光光強(qiáng)能夠反映其與金表面的距離。換句話說,熒光團(tuán)與猝滅金表面的距離越近,發(fā)出的光就越少。改變偶聯(lián)蛋白的流體摩擦力的過程(比如配體結(jié)合,構(gòu)象重構(gòu),熱變性)都會影響DNA運(yùn)動的速度,這導(dǎo)致在擺動的動力學(xué)上發(fā)生變化。
在進(jìn)行動力學(xué)測量之前,我們想要闡明,固定的過程是否會影響Sirt2結(jié)構(gòu)的完整性以及配體結(jié)合的性能。因此,我們在SirReal2存在和不存在時(shí),分別測量了偶聯(lián)的Sirt2的熱穩(wěn)定性(請見Figure 2B).通過 SirReal2對Sirt2 進(jìn)行的固定化處理,即使是在低微摩爾濃度的配體存在下,也能實(shí)現(xiàn)其熱穩(wěn)定性,這表明其折疊狀態(tài)良好且具有有效的配體結(jié)合特性。附著的Sirt2的熱穩(wěn)定性與濃度和時(shí)間均相關(guān)(請見Figure 2B)。
需要注意的是,通過switchSENCE技術(shù)可以發(fā)現(xiàn),在配體濃度為3.3-10uM之間,出現(xiàn)了顯著的熱轉(zhuǎn)移(?T ~ 3 °C)。使用結(jié)合到附著的Sirt2上的SYPRO熒光染料進(jìn)行熒光熱轉(zhuǎn)移檢測,僅僅在25uM的高配體濃度下可檢測到相似的熱轉(zhuǎn)移(?T ~ 3 °C)。
根據(jù)熱穩(wěn)定檢測結(jié)果,我們在配體濃度為2-20uM之間,檢測動力學(xué)。通過采用 switchSENSE® 技術(shù)(動態(tài)模式),我們觀察到未標(biāo)記的 SirReal2從固定化的 Sirt2 上發(fā)生了非常緩慢的解離(請見Figure 2C)。此外,對不同濃度的SirReal2(2.2uM-20uM), 我們獲得了該相互作用的結(jié)合常數(shù) kon ,解離常數(shù) koff 以及 K d 值,其數(shù)值與之前報(bào)道的 Sirt2與我們所使用的標(biāo)記并固定化的 SirReal 基質(zhì)親和探針之間相互作用的數(shù)據(jù)在范圍上高度相似(kon = 6.9 ± 0.22 × 10 3 M-1 s-1 , koff = 7.0 ± 0.31 × 10 -4 s-1 , K d = 0.10 μM)。通過對記錄的數(shù)據(jù)進(jìn)行分析,我們得到了相互作用的常數(shù)kon =7.7 ± 0.2 × 10 2 M-1 s-1 , koff = 4.1 ± 0.1 × 10 -4 s-1。該數(shù)據(jù)為我們提供了總的解離常數(shù)Kd=Koff/Kon=0.53±0.02uM. 這個(gè)K d 值與已報(bào)道的 SirReal2 的 IC 50值高度一致,IC50值為0.44uM。
為了進(jìn)一步驗(yàn)證SirReals較長的結(jié)合時(shí)間是配體本身的特性決定,并非是由于三唑與第97位精氨酸形成的H-鍵的相互作用引起,我們利用 switchSENSE® 技術(shù)確定了含三唑結(jié)構(gòu)的 SirReal 類似物 5 的動力學(xué)參數(shù)。獲得的Koff常數(shù)為7.9 ± 0.6 ×10 -4 s -1 ,與含三唑結(jié)構(gòu)的 SirReal的親和探針獲得的Koff較一致koff = 7.0 ± 0.31 × 10 -4 s-1,以及與由BLI和switchSENCE測得的SirReal2結(jié)合常數(shù)4.1 ± 0.1 × 10 -4 s-1也較一致。因此我們能夠表明,SirReal-Sirt2相互作用較長的結(jié)合時(shí)間是來自于SirReal本身的特性,既不是三唑結(jié)構(gòu)引入的結(jié)果,也不是測量技術(shù)的偏差。
無標(biāo)記switchSENCE技術(shù)檢測SirReal2與Sirt2結(jié)合動力學(xué)

同騰睿杰(上海)生物科技有限公司作為Bruker Dynamic Biosensors中國總代理商,為您提供優(yōu)質(zhì)的售前售后服務(wù)。




