我們發現sirtuin重排配體(SirReals)是RAD+依賴性的Lyrtuin脫乙化酶Sirt 2的高效和選擇性抑制劑。使用生物素化的SirReal結合生物層干涉測量法,我們之前觀察到載體-酶復合物的緩慢分解速度,這被認為是SirReals高親和力和選擇性的關鍵。然而,為了將生物素連接到SirReal核心,我們引入了三唑作為連接部分,X射線共晶體學表明其與輔因子結合環的Arg 97相互作用。在此,我們的目標是闡明觀察到的SirReals的長停留時間是主要由三唑摻入引起的,還是SirReal抑制劑核心的固有特征。因此,我們使用基于電可切換DNA納米層的新型無標簽switchSENSE®技術來驗證SirReals的長停留時間確實是由核心支架引起的。
蛋白質受到各種翻譯后修飾(PTMs)。這些修飾使得蛋白質活性、定位、相互作用和穩定性的微調成為可能。賴氨酸殘基ε-胺的乙酰化具有與磷酸化相似的復雜性和細胞重要性,已成為最豐富的蛋白質PTMs之一。賴氨酸乙酰化由賴氨酸乙酰轉移酶(KATs)安裝,并由賴氨酸脫乙酰酶(KDACs)去除。除了乙酰基之外,還可以通過上述賴氨酸修飾酶安裝和去除更長的酰基鏈,包括丙酰基、丁酰基和肉豆蔻酰基,或衍生自二羧酸如丙二酰基、琥珀酰基或戊二酰基的酰基。然而,值得注意的是,也有相當數量的非酶賴氨酸酰化。在人類基因組中已經鑒定了18種不同的KDACs,并根據它們的序列同源性分成四類。Sirtuins構成了第三類KDAC,是KDAC家族中非常特殊的成員。I類、II類和IV類脫乙酰酶是Zn2+依賴性金屬蛋白酶,而7種人sirtuins同種型(Sirt1-7)共享NAD+依賴性催化機制。在催化反應過程中,sirtuins經歷了從脫輔基酶的所謂“開放構象”到(假)底物結合狀態的“封閉構象”的重排過程。同型Sirt2主要位于細胞質中,并顯示出脫乙酰化多種底物,如α-微管蛋白、BubR1、p53、eIF5A、和nfκb。sir T2依賴性脫乙酰化對細胞周期調節、自噬、外周髓鞘形成、以及免疫和炎癥反應具有重大影響。除了脫乙酰化,Sirt2還催化長鏈脂肪酸的去除,據報道,與脫乙酰化相比,脫酰化的催化效率甚至更高(kcat/Km)。然而,許多最近的報告也表明Sirt2的整個細胞議程不僅依賴于其催化活性,還依賴于其與結合配偶體如KDAC6或TTTP/p25的蛋白-蛋白相互作用(PPI)。Sirt2的失調與幾種疾病狀態有關,包括細菌感染,II型糖尿病,神經退行性疾病,和癌癥,從而突出了sir T2作為藥物干預的有希望的靶標。然而,對于一些疾病情況,包括亨廷頓氏病[21]和一些癌癥類型,尚未最終闡明Sirt2是否必須被上調或下調,分別被抑制以改善特定的疾病狀況。迫切需要合適的工具化合物來進一步研究Sirt2脫乙酰化的細胞效應,并驗證Sirt2作為藥物靶點,這導致了許多藥物樣Sirt2選擇性小分子抑制劑的發現,這些抑制劑已在其他地方進行了綜述。最近,我們發現了一類新的高選擇性Sirt2抑制劑(圖1A)。這些化合物在低微摩爾至納摩爾范圍內導致Sirt2抑制,而對于它們的封閉同系物Sirt1和Sirt3或其他同種型,沒有觀察到可檢測的抑制(IC50 > 100 M)。與1或2復合的Sirt2的共晶體結構(圖1A)是Sirt2與Sirt2選擇性藥物樣抑制劑復合的第一個晶體結構。。該數據揭示了一種獨特的抑制模式,其特征在于配體結合時Sirt2活性位點的主要重排(見圖1B和圖S1)。作為重排的結果,一個新的結合口袋由鉸鏈區的兩個環形成,其連接Rossmann折疊結構域和鋅結合結構域。這種現象僅在Sirt2中觀察到,并歸因于Sirt2在活性位點的這一特殊區域中的獨特靈活性。因此,這類抑制劑被稱為Sirtuin重排配體(SirReals ),形成的誘導型fit結合口袋被稱為選擇性口袋,因為它被確定為Sirt2選擇性的關鍵。在我們報道Sirt2中選擇性口袋的存在后不久,顯示該口袋容納肉豆蔻酰基底物的長鏈脂肪酸。同時,其他Sirt2抑制劑也顯示出通過與選擇性口袋結合而獲得其同種型選擇性。SirReal-Sirt2共晶體結構顯示配體結合到選擇性口袋阻止構象從開放到封閉構象的轉換,對此感興趣,我們假設sir real將sir T2楔入其開放構象(“鎖定-開放構象”),并反過來被該過程捕獲。其揭示了非常慢的解離動力學(圖1C),表明Sirt2確實將結合的SirReal捕獲在其活性位點,這是其在配體結合時構象適應的結果。
這導致配體在其靶上的長停留時間(即配體-蛋白質復合物的壽命),并導致緩慢的解離(圖1C)。發現配體結合時靶蛋白的構象適應可以極大地影響停留時間,這與報道的文獻一致。此外,增加停留時間被認為是優化細胞活性的藥物設計的關鍵策略。然而,如Sirt2與基于三唑的SirReal (5)的復合物的共晶體結構所示,在標記過程中作為接頭部分引入的三唑部分也通過特異性相互作用參與Sirt2結合。三唑與輔因子結合環的Arg97形成氫鍵(圖1B)。為了探究Sirt2親和探針(4)的長停留時間是引入三唑部分的結果還是主要歸因于SirReal核心,我們正在尋找一種能夠在無標記方法中確定結合動力學的技術。
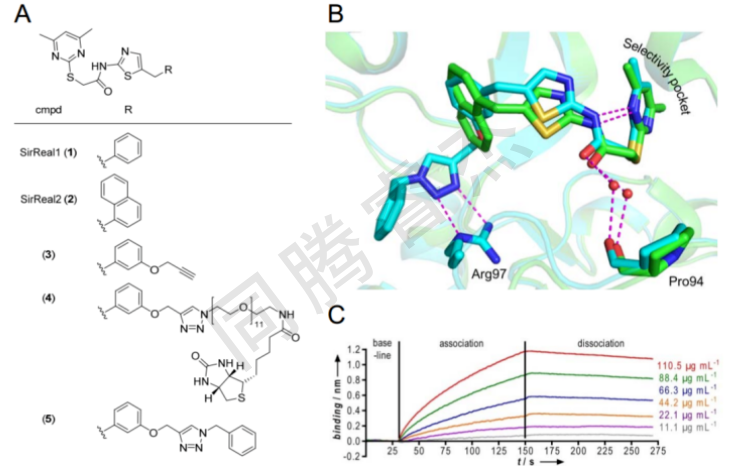
圖1.Sirtuin重排配體(SirReals)通過活性位點重排與Sirt2結合,導致緩慢的關閉動力學。a)選定的SirReal(1-3)、SirReal衍生的親和探針(4)和基于三唑的sir real類似物(5)的化學結構。B)sir real 2(2,綠色,PDB-ID: 4RMG)和基于三唑的SirReal (5,青色,5DY5)結合Sirt2的結合模式的疊加。氫鍵顯示為紫色虛線。相互作用的殘基顯示為棒狀,相互作用的水分子顯示為紅色球體。為了清楚起見,省略了殘基103-112。在圖S1中提供了2和4的結合模式的圖示,其覆蓋了結構的較大部分。c)顯示不同濃度的Sirt2與固定的SirReal衍生的親和探針結合的代表性生物層干涉測量傳感圖(5)。
為了通過不需要標記配體的方法研究Sirt2-SirReal相互作用的結合動力學(kon,koff速率常數),我們利用了基于DNA納米水平的switchSENSE技術。這種方法的靈敏度足以監測未標記的小分子與表面束縛蛋白的結合。在我們用于研究的實驗裝置中,Sirt2共價結合到移植到金微電極表面的雙鏈短DNA納米桿的一條鏈上。另一條鏈用熒光染料標記,在這種情況下是Cy3(圖2A)。一般來說,這種設置可以用于兩種不同的測量模式。在靜態模式下,配體與表面束縛蛋白的結合通過結合事件直接導致的DNA結合熒光團的熒光發射變化來監測。然而,值得一提的是,不直接影響DNA結合的熒光性質的結合事件熒光團不能通過這種測量模式來監控。在SirReal-Sirt2相互作用的情況下,靜態模式測量沒有產生任何可用于進一步評估的結合數據(數據未顯示)。因此,我們使用了switchSENSE技術(動態模式)來進一步表征SirReal-Sirt2相互作用的結合動力學。switchSENSE技術利用施加在金微電極上的交流電勢,可以吸引或排斥雙鏈DNA納米桿的負電荷骨架。
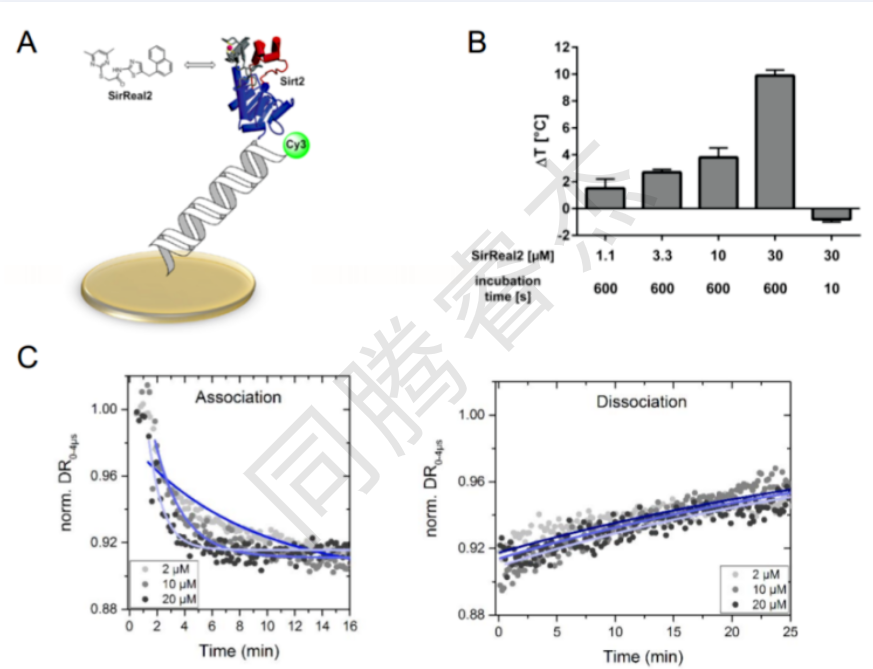
圖2.通過開關傳感技術探測固定的Sirt2和未標記的SirReal2 (2)之間的相互作用。a)實驗裝置的動畫演示。b)由不同濃度的SirReal2誘發的固定化Sirt2的熱穩定性(2)。關于熔化曲線及其評估,請參見圖S3。實驗細節在實驗部分提供。c)固定化Sirt2與SirReal2 (2)的結合(左)和解離曲線(右)。實心圓代表原始數據,全局擬合用藍線表示。
這產生了DNA納米桿方向的振蕩變化,稱為轉換。由于與距離相關的無輻射能量轉移到金,染料發出的熒光強度報告了其到金表面的距離。換句話說,熒光團越靠近猝滅金表面,發出的光越少。改變結合蛋白的流體動力學摩擦的過程(例如,配體結合、構象重排、熱變性)影響DNA運動的速度,從而導致開關動力學的變化。
在我們的動力學測量之前,我們的目的是詢問,固定過程是否影響Sirt2的結構完整性,從而影響其配體結合特性。因此,我們利用switchSENSE技術評估了SirReal2 (2)存在和不存在時系留Sirt2的熱穩定性(見圖2B)。即使在低微摩爾配體濃度下,SirReal2 (2)對固定化Sirt2的熱穩定性也表明了適當的折疊和配體結合性質。受束縛的Sirt2的熱穩定性是濃度和時間依賴性的(圖2B)。值得注意的是,使用switchSENSE技術可以在3.3-10 M的濃度下檢測到顯著的熱位移(T~3°C),而使用SYPRO Orange染料結合未束縛Sirt2的標準熒光熱位移分析(FTSA)僅在25 M的更高化合物濃度下產生類似的位移(T~3°C)[24a]根據熱穩定性分析的結果, 我們的動力學測量是在2-20 M的配體濃度范圍內進行的。通過switchSENSE技術(動態模式),我們觀察到未標記的SirReal2 (2)從固定化的Sirt2中非常緩慢地解離(圖2C)。 此外,對于不同濃度的SirReal2 (2,2M–20M),我們獲得了kon和koff速率常數以及Kd值(見表1 ),與之前報道的Sirt2與我們標記和固定的SirReal親和探針之間的相互作用數據相比,該相互作用的范圍非常相似(4,kon = 6.9±0.22×103M-1s-1,koff = 7.0±0.31×10-4s-1,Kd = 0.10 M)。通過分析記錄的數據集,我們獲得了速率常數kon = 7.7±0.2×102M-1s-1,koff = 4.1±0.1×10-4s-1,這給出了總解離常數Kd = koff/kon = 0.53±0.02M。該Kd值與SirReal2 (2)的IC50值非常一致;IC50 = 0.44m為了進一步證實SirReal的長停留時間是配體核心本身的固有特性,而不是由三唑與Arg97的額外氫鍵相互作用引起的,我們通過switchSENSE技術測定了含三唑的SirReal類似物5的動力學參數(見圖S4)。所獲得的koff常數為7.9±0.6×10-4s-1,與通過biolayer干涉測量法和switchSENSE技術分別測定的基于三唑的SirReal的親和探針(4,koff = 7.0±0.31×10-4s-1)和SirReal2 (2,koff = 4.1±0.1×10-4s-1)的koff常數高度一致。因此,我們能夠證明先前報道的SirReal-Sirt2相互作用的長停留時間是SirReal核心本身的固有特征,既不是摻入三唑部分的結果,也不是應用的測量技術的人工產物。
通過證明SirReal核心(足以誘導Sirt2活性位點的結構重排)[24a]是這類抑制劑緩慢關閉速率的主要驅動因素,我們能夠增加另一個重要證據,即配體結合時的構象適應大大增加了結合配體的停留時間,最終導致高選擇性和高親和力的藥物-靶相互作用。有一個新的爭論,長停留時間(koff)是否真的是比單純的效力或親和力(IC50或Kd)更好的藥物開發成功的預測因素,但我們的研究表明,作為誘導適合機制的結果,長停留時間可能是靶選擇性的重要驅動因素,這是現代藥物發現中最關鍵的參數之一




